 |
 31.01.2008, 19:58
31.01.2008, 19:58
|
#1
|
|
Понятие pH (краткий курс хими воды, для новичков)
Живу я тут
Реєстрація: 31.01.2008
Звідки Ви: Киев
Дописи: 213
сказав Дякую: 36
сказали Дякую 220 раз(и) в 49 повідомленні

31.01.2008, 19:58
Рейтинг:
 (1 голосов - 5,00 средняя оценка) (1 голосов - 5,00 средняя оценка)
Вода является слабым электролитом; она слабо диссоциирует по уравнению
H2O = H+ + OH-
При 25 °С в 1 л воды распадается на ионы 10-7 моль H2O. Концентрация ионов H+ и OH- (в моль/л) будет равна
[H+]=[OH-]=10-7
Чистая вода имеет нейтральную реакцию. При добавлении в нее кислоты концентрация ионов H+ увеличивается, т.е. [H+]>10-7 моль/л; концентрация ионов OH- уменьшается, т.е. [OH-]<10-7 моль/л. При добавлении щелочи концентрация ионов OH- увеличивается, т.е. [OH-]>10-7 моль/л; следовательно, [H+]<10-7 моль/л. На практике, для выражения кислотности или щелочности раствора вместо концентрации [H+] используют ее отрицательный десятичный логарифм, который называют водородным показателем pH:
pH=-lg[H+]
В нейтральной воде pH=7. Для растворов с кислой реакцией pH<7. Для растворов со щелочной реакцией pH>7.
Если учесть, что свойства растворов зависят от активностей находящихся в них ионов, то следует приведенное выражение записать в виде:
pH = lg aH+
В разбавленных растворах значения концентрации и активности совпадают и только при высокой минерализации могут быть значительные расхождения.
В настоящее время pH считается характеристикой активности ионов водорода. Поэтому, иногда в символ pH вводят нижний индекс "a": pHa или paH. Обычно, это делается, когда необходимо явно подчеркнуть отличие определения водородного показателя через концентрацию или активность.
Буферные растворы
Многие аналитические реакции проводят при строго определенном значении pH, которое должно сохраниться в течение всего времени проведения реакции. В ходе некоторых реакций pH может изменяться в результате связывания или высвобождения ионов H+. Для сохранения постоянного значения pH применяют буферные растворы.
Буферные растворы представляют собой чаще всего смеси слабых кислот с солями этих кислот или смеси слабых оснований с солями этих же оснований. Если, например, в ацетатный буферный раствор, состоящий из уксусной кислоты CH3COOH и ацетата натрия CH3COONa добавить некоторое количество такой сильной кислоты, как HCl, она будет реагировать с ацетат-ионами с образованием малодиссоциирующей CH3COOH:
CH3COO- + H+ = CH3COOH
Таким образом, добавленные в раствор ионы H+ не останутся свободными, а будут связаны ионами CH3COO-, и поэтому pH раствора почти не изменится.
При добавлении раствора щелочи к ацетатному буферному раствору ионы OH- будут связаны недиссоциированными молекулами уксусной кислоты CO3COOH:
OH- + CH3COOH = H2O + CH3COO-
Следовательно, pH раствора и в этом случае также почти не изменится.
Буферные растворы сохраняют свое буферное действие до определенного предела, т. е. они обладают определенной буферной емкостью. Если ионов H+ или OH- оказалось в растворе больше, чем позволяет буферная емкость раствора, то pH будет изменяться в значительной степени, как и в небуферном растворе.
Обычно в методиках анализа указывается, каким именно буферным раствором следует пользоваться при выполнении данного анализа и как его следует приготовить.
Для настройки pH-метров применяют стандартные буферные растворы с точными значениями pH.
Принятая в России по стандарту 8.134-74 шкала pH основана на воспроизводимых значениях pH нескольких растворов. Шкала pH обладает внутренней согласованностью, т.е. экспериментально измеренная величина pH не зависит от того, какой из растворов был выбран в качестве стандартного.
Способы измерения pH
Для определения величины pH существуют два основных метода: колориметрический и потенциометрический.
Колориметрический метод основан на изменении окраски индикатора, добавленного к исследуемому раствору, в зависимости от величины pH. Этот метод недостаточно точен, требует введения солевых и температурных поправок, дает значительную погрешность при очень малой минерализации исследуемой воды (менее 30 мг/л) и при определении pH окрашенных и мутных вод. Метод нельзя применять для вод, содержащих сильные окислители или восстановители. Используется обычно в экспедиционных условиях и для ориентировочных определений.
Потенциометрический метод намного точнее, лишен в значительной мере всех перечисленных недостатков, но требует оборудования лабораторий специальными приборами - pH-метрами. Потенциометрический метод основан на измерении ЭДС электродной системы, состоящей из индикаторного электрода и электрода сравнения. Электрод сравнения иногда называют вспомогательным электродом.
Наибольшее практическое применение нашел стеклянный индикаторный электрод, который можно использовать в широком диапазоне pH и в присутствии окислителей.
Кроме стеклянного электрода, для определения величины pH применяются также водородный, хингидронный, сурьмяный и другие электроды. Однако широкого распространения они не получили.
Стеклянный электрод
Стеклянный электрод изготовляется из специальный сортов стекла, о бладающих некоторой электропроводностью, достаточной, чтобы тонкую пленку из такого стекла можно было бы включить в качестве составляющей электрической цепи. Для измерения pH используется стекло, электропроводность которого обусловлена перемещением в стекле ионов H+ (электропроводность любого стекла обусловлена способностью к перемещению катионов относительно неподвижного остова - полианиона полимерной кремниевой кислоты).
Собственно стеклянный электрод представляет собой стеклянную трубку с выдутым на ее конце шариком с очень тонкой стенкой, в которую залита суспензия AgCl в растворе HCl и погружена серебряная проволока. Таким образом, внутри трубки с шариком находится хлорсеребряный электрод. Для измерения pH стеклянный электрод погружают в испытуемый раствор (тем самым не внося в него никаких посторонних веществ). В этот же раствор напрямую или через электролитический ключ погружают электрод сравнения.
Таким образом, образуется гальванический элемент, состоящий из хлорсеребрянного электрода и электрода сравнения, но внутренняя электролитическая цепь этого элемента включает электропроводную стеклянную пленку, а также исследуемый раствор.
В полученной системе перенос электронов от хлорсеребрянного электрода к электроду сравнения, происходящий под действием непосредственно измеряемой разности потенциалов, неизбежно сопровождается переносом эквивалентного количества протонов из внутренней части стеклянного электрода в испытуемый раствор. Если считать концентрацию ионов H+ внутри стеклянного электрода постоянной, то измеряемая ЭДС является функцией только активности ионов водорода, т.е. pH исследуемого раствора.
Определение рН в воде
Определение величины рН воды имеет большое значение при оценке качества природных вод, при оценке коррозивности воды в системах питьевого и промышленного водоснабжения. Этот показатель также важен при обработке питьевой воды, подготовке воды для промышленных установок, при утилизации бытовых и заводских стоков.
Величина концентрации ионов водорода в речных водах обычно колеблется в пределах 6,5-8,5; атмосферных осадках 4,6 - 6,1; болотах 5,5 - 6,0; океане 7,9 - 8,3 рН. рН воды шахт и рудников достигает иногда единицы, а содовых озер и термальных источников десяти. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина рН для большинства речных систем составляет 6,8 - 7,4; летом 7,4 - 8,2.
Фомин Г. С. Вода. Контроль химической, бактериальной и радиационной безопасности по международным стандартам. Энциклопедический справочник. - 2-е изд. перераб. и доп. - М:. Издательство "Протектор", 1995. - 624 с., ил., с. 95-96.
Для поддержания используются корректоры рН+ или рН-, которые увеличивают или уменьшают кислотный показатель воды.
__________________
Сомнения это - достоинство сильных и проклятие слабых.
|
|
Переглядів: 12202
|
|
Ці 8 користувач(ів) сказали Дякую Сан-Техник за це повідомлення:
|
|
 01.02.2008, 00:49
01.02.2008, 00:49
|
#2
|
|
Живу я тут
Реєстрація: 28.06.2003
Звідки Ви: Киев
Дописи: 757
сказав Дякую: 831
сказали Дякую 833 раз(и) в 397 повідомленні
|
Відповідь: Понятие pH (краткий курс хими воды, для новичков) ===www.aquaforum.ua===
Цитата:
Допис від Сан-Техник
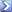
Если учесть, что свойства растворов зависят от активностей находящихся в них ионов, то следует приведенное выражение записать в виде:
pH = lg aH+
|
Небольшая поправка - в правой части пропущен минус. Должно быть так:
pH = -lg aH+
|

|

|
|
cказали "Дякую" Володя Череп за цей допис:
|
|
 01.02.2008, 10:39
01.02.2008, 10:39
|
#3
|
|
Живу я тут
Реєстрація: 31.01.2008
Звідки Ви: Киев
Дописи: 213
сказав Дякую: 36
сказали Дякую 220 раз(и) в 49 повідомленні
|
Ответ: Відповідь: Понятие pH (краткий курс хими воды, для новичков) ===www.aquaforum.ua===
Цитата:
Допис від Володя Череп
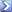
Небольшая поправка - в правой части пропущен минус. Должно быть так:
pH = -lg aH+
|
Респект. Всё верно.
Про жесткость вещать или не надо ;-) ?
__________________
Сомнения это - достоинство сильных и проклятие слабых.
|

|

|
 01.02.2008, 10:41
01.02.2008, 10:41
|
#4
|
|
Член Всеукраїнської Асоціації акваріумістів
Реєстрація: 04.01.2008
Звідки Ви: Севастополь
Дописи: 1.205
сказав Дякую: 889
сказали Дякую 1.405 раз(и) в 504 повідомленні
|
Ответ: Понятие pH (краткий курс хими воды, для новичков) ===www.aquaforum.ua===
вещать. но доступным языком желательно. не все понимают тонкости химии, особенно новички
__________________  
|

|

|
 01.02.2008, 10:58
01.02.2008, 10:58
|
#5
|
|
Живу я тут
Реєстрація: 31.01.2008
Звідки Ви: Киев
Дописи: 213
сказав Дякую: 36
сказали Дякую 220 раз(и) в 49 повідомленні
|
Ответ: Понятие pH (краткий курс хими воды, для новичков) ===www.aquaforum.ua===
Цитата:
Допис від filips
вещать. но доступным языком желательно. не все понимают тонкости химии, особенно новички
|
ОК. Только соображу как бы это по-проще, опустив природу жесткости и сделав акцент на методах коррекции.
Пойду открывать новую тему.
__________________
Сомнения это - достоинство сильных и проклятие слабых.
|

|

|
|
cказали "Дякую" Сан-Техник за цей допис:
|
|
 01.02.2008, 11:17
01.02.2008, 11:17
|
#6
|
|
Живу я тут
Реєстрація: 31.01.2008
Звідки Ви: Киев
Дописи: 213
сказав Дякую: 36
сказали Дякую 220 раз(и) в 49 повідомленні
|
Ответ: Понятие pH (краткий курс хими воды, для новичков) ===www.aquaforum.ua===
Стоп. Не буду повторяться. Вот тут - http://aquaforum.kiev.ua/forum/showt...758#post245758 толково написано.
__________________
Сомнения это - достоинство сильных и проклятие слабых.
|

|

|
|
cказали "Дякую" Сан-Техник за цей допис:
|
|

 |
|
Тут присутні: 1 (учасників - 0 , гостей - 1)
|
|
|
 Ваші права у розділі
Ваші права у розділі
|
Ви не можете створювати теми
Ви не можете писати дописи
Ви не можете долучати файли
Ви не можете редагувати дописи
HTML код Вимк.
|
|
|
Часовий пояс GMT +3. Поточний час: 08:41.
|


